Батарейка из лимона
Зажгите светодиод с помощью. лимона!
Проведите этот опыт с нашей подпиской!
Этот эксперимент, как и Элемент Даниеля, входит в набор Химия и электричество. Подпишитесь и получите всё, что понадобится для проведения этого эксперимента дома.
Реагенты
- Медная проволока
- Магниевая полоска
Безопасность
- Перед началом опыта наденьте защитные перчатки и очки.
- Проводите эксперимент на подносе.
- Не допускайте попадания химических реагентов в глаза или рот.
- Не допускайте к месту проведения экспериментов людей без защитных очков, а также маленьких детей и животных.
- Храните экспериментальный набор в месте, недоступном для детей младше 10 лет.
- Помойте или очистите всё оборудование и оснастку после использования.
- Убедитесь, что все контейнеры с реагентами плотно закрыты и хранятся по правилам после использования.
- Убедитесь, что все одноразовые контейнеры правильно утилизированы.
- Используйте только оборудование и реактивы, поставляемые в наборе или рекомендуемые текущими инструкциями.
- Если вы использовали контейнер для еды или посуду для проведения экспериментов, немедленно выбросьте их. Они больше не пригодны для хранения пищи.
- В случае попадания реагентов в глаза тщательно промойте глаза водой, при необходимости держа глаз открытым. Немедленно обратитесь к врачу.
- В случае проглатывания реагентов промойте рот водой, выпейте немного чистой воды. Не вызывайте рвоту. Немедленно обратитесь к врачу.
- В случае вдыхания реагентов выведите пострадавшего на свежий воздух.
- В случае контакта с кожей или ожогов промывайте поврежденную зону большим количеством воды в течение 10 минут или дольше.
- В случае сомнений немедленно обратитесь к врачу. Возьмите с собой химический реагент и контейнер от него.
- В случае травм всегда обращайтесь к врачу.
- Неправильное использование химических реагентов может вызвать травму и нанести вред здоровью. Проводите только указанные в инструкции эксперименты.
- Данный набор опытов предназначен только для детей 10 лет и старше.
- Способности детей существенно различаются даже внутри возрастной группы. Поэтому родители, проводящие эксперименты вместе с детьми, должны по своему усмотрению решить, какие опыты подходят для их детей и будут безопасны для них.
- Родители должны обсудить правила безопасности с ребенком или детьми перед началом проведения экспериментов. Особое внимание следует уделить безопасному обращению с кислотами, щелочами и горючими жидкостями.
- Перед началом экспериментов очистите место проведения опытов от предметов, которые могут вам помешать. Следует избегать хранения пищевых продуктов рядом с местом проведения опытов. Место проведения опытов должно хорошо вентилироваться и находиться близко к водопроводному крану или другому источнику воды. Для проведения экспериментов потребуется устойчивый стол.
- Вещества в одноразовой упаковке должны быть использованы полностью или утилизированы после проведения одного эксперимента, т.е. после открытия упаковки.
Часто задаваемые вопросы
Всё в порядке. Будучи активным металлом, магний вступает в реакцию с лимонной кислотой (в лимонном соке). В результате образуется цитрат магния и выделяется водород — вот он-то и шипит!
Ничего страшного! Используйте то, что у вас есть. Главное — расположить магний и медь так, чтобы они не соприкасались.
Для начала убедитесь, что вы подсоединили красный зажим к медной проволоке, а черный зажим — к магниевой полоске.
Затем проверьте, подсоединен ли черный зажим-крокодил к короткой ножке светодиода, а красный зажим — к длинной ножке.
Другие эксперименты
Пошаговая инструкция
Подсоедините зажимы-крокодилы к магниевым Mg полоскам и кусочкам медной Cu проволоки.

Вставьте магниевые полоски и кусочки медной проволоки в мякоть лимона.

Подсоедините зажимы-крокодилы к светодиоду. Вот это да! Вы питаете светодиод энергией с помощью лимона!

Утилизация
Пожалуйста, утилизируйте химические отходы эксперимента в соответствии с нормами вашего региона. Остальные твердые отходы утилизируйте вместе с бытовым мусором. Растворы слейте в раковину и затем тщательно промойте ее водой.
Что произошло

Электроны 





Из чего еще можно сделать батарейку?
Представьте, что вам срочно нужно электричество, а под рукой нет меди Cu и магния Mg. Подойдут и другие па́ры металлов! Чтобы подобрать хорошую пару, воспользуйтесь «электрохимическим рядом активности металлов». В этом ряду металлы отдают электроны всем металлам, стоящим справа от них (так же, как магний отдавал электроны меди). Чем дальше друг от друга находятся металлы в этом ряду, тем лучше они делятся электронами по проводу.
Если так получилось, что под рукой нет лимона, возьмите любой сочный фрукт, овощ или любой раствор с большим количеством ионов. Подойдут подсоленная вода, минералка или сок.

Как работает батарейка из лимона?
Магний активнее меди. Если эти два металла входят в одну электрохимическую ячейку, электроны в ней будут перемещаться через светодиод от магния к меди. Именно благодаря такому перемещению электронов светодиод загорается. Электроны — отрицательно заряженные частицы, поэтому на медной проволоке будет накапливаться избыточный отрицательный заряд.
В таких условиях и медь, и магний чувствуют себя некомфортно, но на помощь приходит лимон. То есть не сам лимон, а его сок, содержащий лимонную кислоту. В растворе лимонная кислота частично распадается на цитрат-анионы и ионы водорода H + (протоны). Другими словами, лимонный сок работает как раствор электролита, способный проводить электрический ток. Затем протоны забирают у медной проволоки избыточные электроны и образуют молекулы водорода:
В то же время положительно заряженные ионы магния покидают магниевую полоску и переходят в раствор. Это означает, что магниевая полоска постепенно растворяется:
Ионы магния будут переходить в раствор, пока магниевая полоска полностью не растворится.
Как работает раствор электролита?
Как правило, электролитом является вещество, способное при растворении распадаться на ионы. Собственно, так и получается раствор электролита. Электролитом может быть не только лимонная кислота, но и хлорид натрия (поваренная соль), и вообще практически любая водорастворимая соль. При растворении электролита образуются и отрицательно (анионы), и положительно (катионы) заряженные ионы. Они помогают поддерживать баланс между зарядами в ячейке, убирая избыточный положительный или отрицательный заряд с металлических составляющих батарейки. Без такого баланса батарейка не смогла бы работать.
Подпишитесь на наборы MEL Chemistry и проведите эти опыты у себя дома!
Лимонная батарейка!
Представляешь, как изменилась бы наша жизнь, не будь в ней батареек? Если бы не было этого удобного способа хранения электричества, мы бы не пользовались всеми нашими электронными девайсами вроде мобильного телефона, планшета, ноутбука. Не было бы и многих других привычных вещей – от радиоуправляемых машинок с фонариками до слуховых аппаратов. Им всем тоже нужна розетка, чтобы работать.
В 1800 году Алессандро Вольта изобрел первую батарею. С тех пор ученые трудились не покладая рук, чтобы ее постоянно совершенствовать. Сложи вместе все эти годы научной работы и все то разочарование, которое постигает тебя, когда батарейка садится. А теперь представь – ты можете ее сделать дома, из подручных средств! Попробуй, и это наверняка «зарядит» твое воображение!
Немного информации
Батареи – это контейнеры, которые хранят химическую энергию, которая может быть преобразована в электрическую, другими словами – в электричество. К образованию энергии приводит электрохимическая реакция. Реакция обычно происходит между двумя кусками металла, называемыми электродами, и жидкостью или пастой, называемой электролитом. Чтобы батарея работала хорошо, электроды должны быть сделаны из двух разных металлов. Это гарантирует то, что один электрод будет вступать в реакцию с электролитом отличную от той,которая произойдет между другим элеткродом и электролитом. Это различие и есть источник энергии. Соедини два электрода с материалом, который хорошо проводит электроэнергию (так называемый проводник) и запусти химическую реакцию! Батарея генерирует электричество! Делая соединения, помни: электричество выбирает пути наименьшего сопротивления. И если есть несколько путей от одного электрода к другому, электричество выберет самый простой из них.
Теперь, когда ты знаешь основные принципы работы батареек, давай посмотрим, что есть в нашем доме. Алюминиевая фольга – прекрасный проводник, электричество легко проходит через нее. Кстати, наше тело – тоже отличный проводник, но не такой хороший, как алюминиевая фольга. Электродами послужат медные монетки, спрятанные в свинку-копилку. Что же до электролитов – их полно на нашей кухне, и один из них – лимонный сок.
Да-да, сделать батарею своими руками гораздо проще, чем ты мог подумать!

Материалы
- Две медные монетки
- Вода
- Несколько капель средства для мытья посуды
- Бумажные полотенца
- Алюминиевая фольга (девять отрезков по 60 сантиметров)
- Ножницы
- Линейка
- Лимон (желательно с кожицей)
- Тарелка
- Нож (и помощь взрослого человека при его использовании)
- Две скрепки с пластиковым покрытием
Подготовка
- Вымой монетки в мыльной воде, затем обсуши их бумажным полотенцем; это удалит грязь, которая могла к ним прилипнуть.
- Аккуратно вырежи три прямоугольника из алюминиевой фольги размером 3 х 20 см.
- Сложи каждую полосу три раза, чтобы получить три крепкие алюминиевые полоски толщиной 1 см и длиной 20 см.
- Примечание: В этом упражнении мы будем делать батареи очень низкого напряжения. Количество электроэнергии, вырабатываемой этой самодельной батареей, является безопасным, и ты сможешь протестировать ее, почувствовав слабый ток при нажатии пальцем. Более высокое напряжение электроэнергии может быть очень опасным и даже смертельным; ты не должен экспериментировать с батареями из магазина или розетками!
Процесс
- Положи лимон на бок на тарелке и попроси взрослого сделать небольшой надрез в середине лимона. Сделайте разрез около двух сантиметров в длину и один сантиметр глубиной.
- Сделайте второй аналогичный разрез на расстоянии около одного сантиметра от первого и параллельно ему.
- Вдави монетку в первый разрез, пока над кожей лимона не останется только половинка монеты. Часть монетки должна быть в контакте с лимонным соком, потому что именно он служит электролитом. Сама монетка в контакте с лимонным соком служит в качестве первого электрода.
Примечание: Если у твоего лимона очень толстая кожа, тебе, возможно, потребуется помощь взрослого, чтобы аккуратно срезать лишнюю цедру.
Догадываешься, почему так важно, чтобы часть монетки была в контакте с лимонным соком?
- Помести одну из алюминиевых полосок во второй разрез, убедись, что часть алюминия находится в контакте с лимонным соком.
Угадай, какой частью батареи служит алюминиевая полоса внутри лимона? Как ты думаешь, важно ли, чтобы алюминий был в контакте с лимонным соком?
- Ты только что сделал батарейку! Она имеет два электрода, изготовленных из различных металлов и электролит, разделяющий их.
Как ты думаешь, будет ли эта батарея вырабатывать электроэнергию, или ей чего-то не хватает?
- Твой аккумулятор может вырабатывать электроэнергию, но будет делать это только тогда, когда электроды будут соединены с чем-то, что проводит электричество. Для этого прикрепи вторую алюминиевую полосу к части монетки, торчащей из лимона, скрепкой с пластиковым покрытием. Убедись, что алюминий касается монетки и электроэнергия может пройти между медью и алюминием.
Ты использовал алюминиевую полоску, чтобы создать соединение. А пластиковая полоска сработала бы?
Знаешь, почему тебе не нужно создавать подключение ко второму электроду для этой конкретной батарейки?
- Как только две алюминиевые полоски соприкоснутся друг с другом, в батарее будет вырабатываться электричество, оно будет проходить через полоски, от одного электрода к другому. Ты не можешь видеть электричество, но можешь почувствовать его. Держи две полоски на расстоянии одного сантиметра друг от друга и прикоснись к ним пальцем.
Чувствуешь покалывание от небольшого количества электроэнергии, которая проходит от одной алюминиевой полоски в другую через твое тело?
- Чтобы получить больше электрического сока (и немного более сильные ощущение покалывания), можешь сделать вторую батарею, идентичную первой. Выбери другое место на этом лимоне или используй второй лимон, чтобы сделать второй аккумулятор. Обрати внимание, что тебе для этого понадобится только одна алюминиевая полоска. Для подключения второй к первой нужно найти алюминиевую полосу на первой батарее, которая служит электродом (ее кончик вставлен в лимон). Используй скрепку с пластиковым покрытием, чтобы прикрепить другой конец этой алюминиевой ленты к монетке второго аккумулятора. Это соединит алюминиевый электрод первого аккумулятора с медным электродом второго аккумулятора.
- Протестируй набор подключенных батарей так же, как тестировал одну батарею, чтобы концы алюминиевой фольги торчали из твоего приспособления (те, что имеют свободный конец) и были в контакте с твоими пальцами.
Чувствуешь электроэнергию? А в первом случае чувствововал? Есть ли разница в ощущениях?
Внимание: Если что-то не получилось, проверь, касаются ли монетки-электроды и алюминиевые полоски-электроды лимонного сока-электролита. Проверь контакт между фольгой и монеткой, алюминиевые полоски не должны касаться друг друга. Если все правильно, но ты по-прежнему не чувствуешь ток, попроси своего друга или родителей опробовать твою батарею. Может, электричества недостаточно. Тогда нужно смастерить еще одну батарею.
Дополнительно
- Теперь, когда ты научился определять, есть ли в нашей батарее электричество, попробуй разные конфигурации.
Что произойдет, если алюминиевые полоски будут касаться друг друга? Что будет, если ты заменишь фольгу на пластиковую полоску или на зубочистку?
- Способ, которым ты воспользовался в этом опыте, ученые называют «последовательным соединением батарей в цепи».
Как ты думаешь, количество батарей в цепи влияет на то, какую силу тока ты чувствуешь?
- Попробуй использовать другие комбинации металлов.
Что будет, если в качестве электродов будут использоваться две монеты? А что будет, если один из электродов будет медным, а второй никкелевым?
Имей в виду, иногда сила тока может быть настолько слабой, что ты ее не почувствуешь. Соедини две или более батарей такого типа, тогда ты наверняка сможешь проверить, работают ли они.
- Мы использовали лимон в качестве электролита для батареи.
Как ты думаешь, нам подойдут другие фрукты или овощи? Можно ли сделать батарею из картофеля, яблока или лука? Поэкспериментируй на кухне (с разрешения родителей, конечно). Какой фрукт или овощ подойдет для батареи лучше всего?
- Если у тебя есть светодиод, можно исследовать, как много лимонных батарей необходимо, чтобы его зажечь.
Наблюдения и результаты
- Почувствовал ли ты покалывание в подушечках пальцев? Аккумуляторы, которые ты только что сделал своими руками, имеют медный и алюминиевый электроды, разделенные электролитом – лимонным соком. Твой аккумулятор будет генерировать электричество тогда, когда у электричества появится путь от одного электрода к другому. Мы проложили этот путь с помощью алюминиевых полосок, ведь алюминий – отличный проводник.
- Когда ты потрогал алюминиевую полоску пальцами, ты пропустил немного электричества через свое тело, которое тоже является проводником. При этом ты мог почувствовать небольшое покалывание в подушечках пальцев. У одного человека оно может быть сильнее, у другого – слабее. Пластик и дерево – плохие электрические проводники. Используя их, ты не почувствуешь электричества. Металлы же, напротив, отлично проводят электричество. Использование разных металлов в качестве электродов позволит генерировать разное количество электричества. А вот при использовании одного и того же металла в качестве электродов электричество вырабатываться не будет.
- В этом опыте ты создал аккумулятор с очень низким напряжением. Никогда не экспериментируй с батарейками из магазина или розетками! Это опасно для жизни!
Дети будут в восторге: опыт с получением электричества из лимона
Дата публикации: 27 января 2020
- Что понадобится для опыта по получению электричества из лимона
- Добываем электричество из лимона: пошаговая инструкция.
- Объяснение опыта
Чтобы проводить научные эксперименты, не нужны оборудованная химическая лаборатория и звание ученого. Многие из нас наверняка помнят опыт с получением электричества из лимона, который мы делали на физике в школе. Попробуйте повторить его со своими детьми, младшими братьями и сестрами или самостоятельно. Получится интересно и не сложно. Итак, приступим: как сделать электричество из лимона и превратить его в настоящую батарейку?
Что понадобится для опыта по получению электричества из лимона
Подобные опыты можно проводить с картофелем, киви, яблоками и другими овощами и фруктами. Но именно лимон дает наибольшее напряжение благодаря лимонной кислоте. Для этих же целей подойдет и банка с электролитом, но купить ее в магазине за углом не получится. К тому же использование электролита опасно.

Подготовим ингредиенты
- минимум два лимона средней величины;
- минимум одна медная проволока (можно заменить монетой) длиной в 5-6 сантиметров;
- цинковая пластинка (заменить можно на металлический шуруп, болт, саморез или проволоку);
- короткие (10-30 сантиметров) тонкие соединительные провода;
- мультиметр, чтобы определить вольтаж;
- любой светодиод в качестве лампочки (с его помощью вы увидите наличие тока).
Об отличиях люминесцентной лампы от ламп со светодиодами можно почитать здесь — Анализ и сравнение параметров ламп

Когда приготовления закончены, можно приступать к самой интересной части — проведению опыта.
Добываем электричество из лимона: пошаговая инструкция.
Чтобы получить электричество из лимона, необходимо выполнить шесть последовательных действий. Но помните о безопасности! Рекомендуется надеть перчатки и очки (особенно детям), а сам опыт проводить на подносе или разделочной доске.
- Шаг первый. Берем один лимон, промываем его и насухо вытираем. Затем фрукт необходимо слегка размять в руке.
- Шаг второй. На бока лимона поместите проводники — с одной стороны медную проволоку, а с другой — металлический болт или цинковую пластину. Проводники должны уходить вглубь фрукта на 2-3 сантиметра.
- Шаг третий. К медному и металлическому проводникам присоединяем недлинные провода.
- Шаг четвертый. С помощью мультиметра измеряем напряжение. Должно быть около 1 вольта.
- Шаг пятый. Проделываем шаги с первого по четвертый со вторым лимоном.
- Шаг шестой. Соединяем две батарейки между собой. Для этого с помощью одного провода наискосок скрепляем медный и металлический (или цинковый) проводники на разных лимонах. К оставшимся двум проводникам также присоединяем провода.

Почти все готово! Осталось к торчащим концам соединительного провода аккуратно прикрепить светодиод. Если вы все сделали верно, то маленькая лампочка загорится. Мы добыли электричество из лимона! Кстати, чем больше лимонов использовать и последовательно соединять между собой, тем большее напряжение они выдадут. Чтобы зажечь стандартную лампочку, понадобится около 15 лимонов.
Объяснение опыта
Цинк и медь, из которых изготовлены взятые проводники, при контакте с лимонной кислотой запускают химическую реакцию. В итоге медный проводник становится положительно заряженным, а цинковый или металлический — отрицательно.
После этого мы соединили заряженные проволоку и болтик проводом, создав замкнутую сеть, в которой и образовался электрический ток. В результате получилась батарейка со слабым зарядом.
Работать лимонная батарейка может до нескольких часов, пока длится химическая реакция. Опыт можно попробовать провести с большим количеством лимонов. Но не рекомендуем экспериментировать с покупными магазинными батарейками. Это может быть опасно.
 Биотопливо для авто. Топливо XXI века?
Биотопливо для авто. Топливо XXI века? Технологические особенности производства биотоплива
Технологические особенности производства биотоплива Великая миссия. Биотопливо из мусора
Великая миссия. Биотопливо из мусора Вихревой теплогенератор: принцип действия, преимущества, схемы и рекомендации для самостоятельной сборки
Вихревой теплогенератор: принцип действия, преимущества, схемы и рекомендации для самостоятельной сборки
Вам нужно войти, чтобы оставить комментарий.
Электричество из лимона, апельсина, картофеля – как это возможно?
Желая просто удовлетворить свое любопытство или оказавшись по какой-нибудь причине вдали от цивилизации, где нет ни аккумуляторов, ни батареек, добыть электричество для питания светодиодного фонарика можно при помощи доступных плодов растений: картошки, яблока, апельсина, лимона, лука и т. д. Достаточно иметь под рукой какие-нибудь соединительные провода, и совсем идеально было бы раздобыть вдобавок цинк и медь.
Проверить данную идею можно буквально на коленке: воткните в картофелину с одной стороны медную монетку или кусок медного провода, а с другой стороны — гвоздь или канцелярскую скрепку. При помощи вольтметра у вас тут же получится измерить напряжение в районе 1 вольта между данными электродами.

А суть здесь вот в чем. Клубень картофеля, яблоко, лимон, апельсин и т. д. – от природы содержат в себе не только сложные полезные вещества и витамины, необходимые нашему организму для питания.
Сок данных плодов является еще и природным электролитом, это значит, что в таком соке содержатся кислота и растворенные в ней соли. Следовательно яблоко (даже неспелое и маленькое), картофелину, лимон или апельсин, можно реально применить в качестве составной части химического источника тока, корпус ячейки которого уже готов благодаря самой природе.
Итак, что же происходит, когда мы втыкаем в такой плод с одной его стороны оцинкованный гвоздь, а с другой — медную проволоку, и замыкаем цепь? Гвоздь станет отрицательным электродом – анодом, с него электроны будут утекать в нагрузку, так как в кислой среде начнется реакция окисления цинка с высвобождением электронов. При этом каждый атом цинка отдает по два электрона.
Медь служит здесь катодом — положительным электродом. Медь является сильным окислителем, она притягивает к себе такое же количество электронов, сколько отдает цинк. То есть на катоде протекает химическая реакция восстановления. Так в цепи инициируется протекание электрического тока.
На поверхности меди реакция восстановления протекает так: положительно заряженные ионы водорода, содержащиеся в кислоте, получают недостающие электроны от цинка и превращаются в водород. Водород выходит наружу в виде пузырьков.
Около катода (меди) формируется высокая концентрация отрицательно заряженных ионов кислоты, а около анода (цинка) — положительно заряженных ионов цинка. Ионный обмен между электродами внутри такой батарейки приводит к непрерывной балансировке зарядов в электролите, когда цепь замкнута.
Что касается изначальной разности потенциалов между электродами, (когда цепь разомкнута) то она будет зависеть здесь от двух факторов: от кислотности среды и от разности электрохимических потенциалов металлов, из которых сделаны электроды. Таблица электрохимических потенциалов металлов поможет понять это более наглядно.
Таблица электрохимических потенциалов металлов
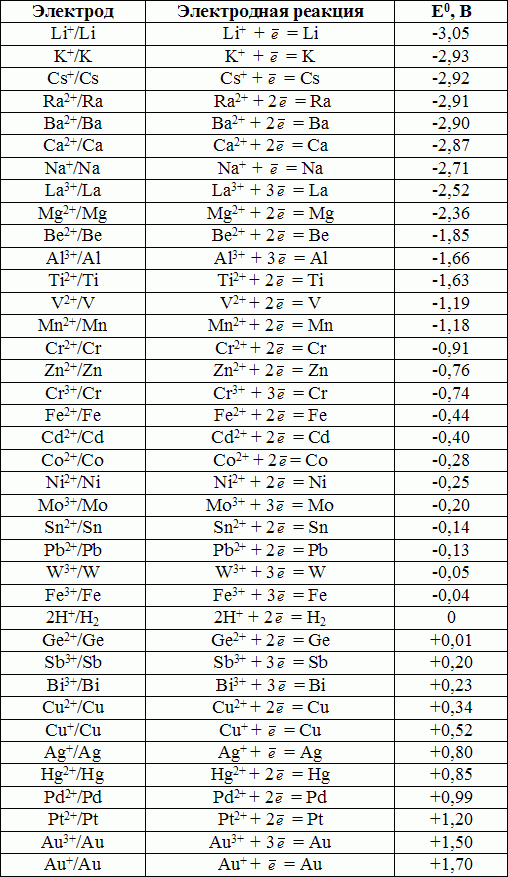
В качестве положительного электрода целесообразно брать металл, стандартный электрохимический потенциал которого положителен относительно водорода (например Cu – медь имеет электрохимический потенциал +0,34 В). Чтобы сделать отрицательный электрод, необходимо взять металл, стандартный электрохимический потенциал которого отрицателен по отношению к водороду ( например Zn – цинк имеет электрохимический потенциал -0,76 В). Разность получается довольно значительной, а именно 1,1 В.

Соединив последовательно несколько таких элементов, можно получить большее напряжение. Чтобы увеличить ток — соединяйте элементы параллельно, при этом используйте электроды по возможности большего размера, чтобы площадь взаимодействия металла с электролитом получилась бы больше, и окислительно-восстановительная реакция могла протекать активнее (смотрите – Схемы соединения аккумуляторов: параллельное и последовательное подключение).
Известен случай, когда один британский студент на протяжении недели пользовался музыкальным плеером, заряжая его при помощи цинка, меди и лука, пропитанного фруктовым напитком.
Фруктовая батарейка

Природные аккумуляторы электрической энергии, батарейка из фруктов – возможно ли это? Давайте попробуем разобраться с этим вопросом в нашей лаборатории.
Нужно отметить, что этот эксперимент хорош своей простотой и наглядностью. Его можно использовать как для школьного научного проекта (особенно, добавив теоретический раздел), так и в виде развлечения устроив неплохую презентацию, например, для друзей. Замечательно подойдет этот опыт и если вы просто решили с пользой провести время с ребенком – и весело, и познавательно!
В предыдущей статье об устройстве батарейки мы немного затронули историю создания батарейки, узнали, откуда в ней берется электричество, рассмотрели протекающие в гальваническом элементе процессы. А невероятно полезный метод познания окружающего мира под названием «Что там внутри?» помог нам посмотреть, из чего состоит батарейка. Правда, пришлось разломать несколько гальванических элементов, но в этой статье, обещаю, мы ломать ничего не будем. Только созидать!
Что нам для этого понадобится? Как мы уже выяснили, любой гальванический элемент состоит из электродов и электролита. Следуя традиции, никаких экзотических или труднодоступных материалов мы использовать не будем. Если вам захочется повторить эксперимент, потребуется следующее:
- Овощи или фрукты, которые есть у вас под рукой. Только не говорите окружающим, для чего они вам нужны, а то в следующий раз, когда вам захочется, скажем, апельсинчика, вам не дадут – скажут, мол, опять собираешься продукты переводить Они будут исполнять роль электролита в нашей партии батарейки (а точнее, содержащийся в них фруктовый сок, который благодаря фруктовым кислотам выполняет роль ионообменной среды).
- Железные и оцинкованные гвозди. Если нет оцинкованных гвоздей, можете взять кусочки оцинкованной жести. Если после предыдущей статьи по устройству батареек у вас остался цинковый корпус – самое время достать его из заветной коробочки. Как вы поняли, все это будет выполнять роль электродов.
- Несколько проводков. Я взял несколько жил от многожильного кабеля типа «витая пара». Провода нам нужны для того, чтобы организовать электрическую цепь – тот самый мостик, по которому электроны бегут от одного электрода к другому.
- Ну и конечно же нам потребуется потребитель тока – зачем нам электричество, если нам некуда его тратить. В качестве потребителя стОит использовать что-нибудь маломощное: например калькулятор или светодиод. Что-либо помощнее, например, лампу накаливания, брать не стоит. Хотя, последним замечанием можно пренебречь, если у вас перед домом стоит грузовик с лимонами.
Разложим компоненты на нашем лабораторном столе.
Зачищаем от изоляции концы проводов.

Начинаем погружать электроды в электролит. Ну а если по-простому – то втыкать гвозди и пластины в заготовленные съестные припасы. Сначала один электрод…

… а затем и другой.

На концах электродов закрепляем провода.


Гальванический элемент готов! Половинка лимона показывает почти полвольта.

Проделав все вышеописанные процедуры с яблоком, видим, что гальванический элемент из этого фрукта дает аналогичное напряжение.

Аналогичное напряжение обеспечивает и апельсин.

А вот лук преподнес сюрприз. Батарейка из него получилась высоковольтная

А теперь давайте посмотрим, на что способна вся эта наша фруктово-электрическая братия. Конечно, каждый из этих элементов мало на что способен. Разве что просто продемонстрировать с помощью вольтметра, что электричество они вырабатывают на самом деле. Гораздо более эффектным будет демонстрация работы потребителей тока от наших фруктовых батареек. Как я уже отметил, напряжения, выдаваемого отдельным фруктовым гальваническим элементом, будет недостаточно для питания даже маломощных потребителей тока. Следовательно, нам нужно повысить напряжение. Этого можно достигнуть путем соединения нескольких гальванических элементов по последовательной схеме, т.е. вот так:
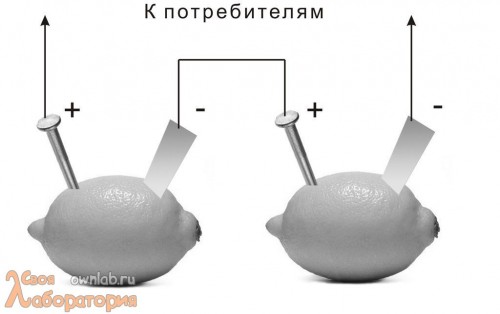
После соединения всех наших гальванических элементов в батарею получаем уже вполне солидное напряжение.

Попытаемся подключить светодиод (при подключении необходимо соблюсти полярность)… Горит.

Даже старый калькулятор, который я уже давно перестал считать рабочим, заработал от фруктовой батареи!

Ну что ж, опыт удался! Как видим, батарейка из фруктов вполне реальна. Конечно, как серьезный источник питания ее рассматривать нельзя. Но как отличный наглядный материал о природе электричества, который для непосвященных может выглядеть даже немного мистически, — вполне!
Фруктовые батарейки
Фруктовые батарейки
Моя работа посвящена необычным источникам энергии.
В интернете я прочитал о том, что индийские ученые работают над созданием необычных батареек для несложной бытовой техники с низким потреблением энергии. Внутри этих батареек должна быть паста из переработанных бананов и апельсиновых корок. Одновременное действие четырех таких батареек позволяет запустить стенные часы, а для ручных часов хватит одной такой батарейки.
Еще я узнал, что компания Sоnу на научном конгрессе в США представила батарейку, работающую на фруктовом соке. Если «заправить» такую батарейку 8 мл сока, то она сможет проработать в течение одного часа. Применяться новинка может в плеерах, мобильных телефонах.
А группа ученых из Великобритании создала компьютер, источником питания для которого является картошка. За основу был взят старый компьютер с маломощным процессором Iпtе1 386. В него вместо жесткого диска поставили карту памяти на 2 мегабайта. Питается это устройство 12 картофелинами, которые меняются каждые 12 дней.
Я задумался над вопросом, зачем люди тратят время на создание «фруктовых» батареек, ведь уже создано большое разнообразие батареек, аккумуляторов и других элементов питания. Ответ показался мне очевидным. Мы очень часто покупаем элементы питания для игрушек, часов, фонариков, телефонов. На это тратятся денежные средства. Возможно, что можно заменить дорогие гальванические элементы самодельными фруктовыми и овощными батарейками, тогда будет экономия.
Если верить интернет-источникам, то когда у меня дома отключат электричество, я смогу некоторое время освещать его при помощи лимонов.
Я решил проверить лично, возможно такое или нет.
В данном проекте мною была исследована возможность получения источников питания из фруктов и овощей.
Я поставил перед собой следующие задачи:
1. Создать фруктовые и овощные батарейки.
2. Экспериментально определить напряжение таких батареек.
3. Выяснить, от чего зависят электрические свойства таких батареек.
4. Постараться зажечь лампочку с помощью фруктовой батарейки.
Лимонная батарейка
Даже из этого фрукта можно получить электроэнергию. Для этого нужно подготовить следующие вещи:
- один лимон;
- кусок чего-нибудь стального;
- нечто из меди;
- и два отрезка провода для изоляции.
Сперва нам будет нужно провести зачистку наших предметов из стали и меди. В этом поможет обычная наждачная бумага.
Справка. Предметом из стали могут быть самые обыкновенные гвозди. Их полно в любом гараже. А для «нечто из меди», можно использовать монетки достоинством в десять и пятьдесят копеек.
Теперь втыкаем в лимон гвоздь и монетку. Между ними нужно сделать зазор примерно в три сантиметра. Это будут наши электроды, остаётся присоединить к ним провода. Можно просто вплотную рядом воткнуть. Монетка — это наш положительный контакт, а гвоздь, стало быть — отрицательный. 
Справка. Лимон с успехом заменяется обычным яблоком. Главное — выбрать самое кислое, которое не жалко на опыты пустить. А кислота полезна для протекания реакции.

Лимонная или яблочная батарейка (если брать лишь один плод), выдаст около 0,5 или 0,7 вольт. Это очень мало — даже самый простой мобильник не зарядишь. Нужно как-то довести напряжение до трёх или даже пяти вольт. Но как? Да очень просто — соединить в единую цепь больше плодов.
Справка. Чтобы увеличить заряд нашей цепи, её можно и зарядить. В цепь достаточно включить батарейку крона или даже зарядное устройство от мобильного телефона.

Заставить лимоны или яблоки вырабатывать электричество становится возможным, так как медный элемент взаимодействует со стальным. Кислота, которая содержится внутри плодов, запускает эту реакцию. Пока внутри имеется хоть капля кислоты или пока целы контакты — батарейка будет продолжать свою работу.
Закончив поиски нужных предметов, можно приступать к самому интригующему. Созданию тока! Как же из лимона сделать батарейку?
Обязательно нужно подготовить фрукты. Цитрусы необходимо тщательно размять, надавливая пальцами и с нажимом катая по столу до тех пор, пока они не станут мягкими. Потеря упругости означает, что они выделили большое количество сока внутри. Чем его больше, тем лучше. Именно от количества сока, который играет роль электролитического раствора, зависит успех эксперимента.
После этого нужно закрепить на батарейке из лимона электроды. С одной стороны аккуратно вставляем положительный (медная монета), а с другой стороны -отрицательный (цинковый болт) электроды. Лучше вставлять их примерно на треть или половину длины, оставляя место для проводков.
Еще один важный момент — электроды не должны прикасаться друг к другу ни внутри, ни снаружи фрукта. Иначе обязательно возникнет короткое замыкание.
Сверху на электроды необходимо аккуратно закрепить проводки. Если они будут иметь зажимы на концах, то это существенно облегчит процесс и упросит задачу.

Яблочная батарейка

Яблочная кислота также, как и лимонная способная давать химическую реакцию с металлами.
Для изготовления понадобятся:
- цинковые шурупы — 3 шт.;
- стальные шурупы — 3 шт.;
- сочное яблоко — 3 шт.;
- зажимы-крокодилы — 4 шт.
Процесс сборки яблочной батарейки:
- Вставить в каждое яблоко по двум сторонам шурупы из разных металлов.
- Соединить их зажимами-крокодилами так, чтобы один конец был прикреплен к цинковому шурупу, а другой к стальному. В итоге на концах цепи останется по одному свободному зажиму.
- Закрепить эти зажимы, например, на лампочке или мультиметре, присоединив крокодил, прикрепленный с одной стороны к шурупу из цинка, к минусовой клемме, а второй к плюсовой.
Среднее напряжение от цепи из трех яблок — 1,32 Вт.
Эти батареи без труда можно изготавливать дома, подстелив под ингредиенты клеенку или подставив поднос для защиты поверхности от химической реакции. Чтобы усилить напряжение в любой из самодельных батареек, нужно увеличивать количество предметов, указанных в инструкции и брать шурупы, болты или гвозди большего размера, так как напряжение напрямую зависит от площади соприкосновения металла с проводником.
Как сделать батарейку из лимона
Как сделать батарейку из лимона?
В действительности соорудить подобную установку можно из любого фрукта. Вся разница будет лишь в напряжение. У лимона есть преимущество, в нем имеется лимонная кислота. Она способна генерировать больший электрический ток.
Вот что потребуется для создания лимонной батарейки:
- Лимон – 1-2 штуки.
- Медная проволока в количестве 1 штуки. Для масштабного эксперимента можно взять по больше. Если нет, можно использовать монетку.
- Цинковая пластина. В ее роли может выступать обычный металлический болт, шуруп или проволока.
- Мультиметр или тестер для определения напряжения.
- Светодиод. Он позволит зафиксировать наглядно что ток имеется.
Как видите в основе изготовления этой батареи лежат всего три вещи.
Шаг №1.
Возьмите лимон и немного его помните. Так же при желании можете помыть и протереть. Хотя это не так важно.

Шаг №2.
Поместите на небольшую глубину до 2 см медный проводник и недалеко от него металлический.

Подсоедините к торчащим прутикам провода.

Протестируйте мультиметром сколько данная установка выдает вольт.

В итоге 0,91 вольт!
Соберите вторую лимонную батарейку и соедините их последовательно. Либо воткните еще медный и металлический провод. Затем наискосок соедините их между собой.
Дело в том, что светодиод не будет гореть от одной батарейки, поэтому потребуется вторая.
Таким образом батарейка из лимона стабильно может выдавать электрический ток.
Объяснение: Работа подобного элемента питания основана на взаимодействии двух проводников разноименных металлов. После того как их помещают в лимон их окружает среда из лимонной кислоты. Это вещество служит электролитом. То есть начинает течь химическая реакция и ионы перемещаются, выдавая энергию.
В место монеты лучше всего использовать проволоку медную.
Видео
Часто задаваемые вопросы
Лимонный сок около магниевой пластины шипит. Это нормально? Всё в порядке. Будучи активным металлом, магний вступает в реакцию с лимонной кислотой (в лимонном соке). В результате образуется цитрат магния и выделяется водород — вот он-то и шипит!
У меня нет целого лимона. Хватит ли для опыта небольшого кусочка? Ничего страшного! Используйте то, что у вас есть. Главное — расположить магний и медь так, чтобы они не соприкасались.
Светодиод не загорается. Что делать? Для начала убедитесь, что вы подсоединили красный зажим к медной проволоке, а черный зажим — к магниевой полоске. Затем проверьте, подсоединен ли черный зажим-крокодил к короткой ножке светодиода, а красный зажим — к длинной ножке.
Утилизация
Пожалуйста, утилизируйте химические отходы эксперимента в соответствии с нормами вашего региона. Остальные твердые отходы утилизируйте вместе с бытовым мусором. Растворы слейте в раковину и затем тщательно промойте ее водой.
Эксперимент!
Закончив поиски нужных предметов, можно приступать к самому интригующему. Созданию тока! Как же из лимона сделать батарейку?
Обязательно нужно подготовить фрукты. Цитрусы необходимо тщательно размять, надавливая пальцами и с нажимом катая по столу до тех пор, пока они не станут мягкими. Потеря упругости означает, что они выделили большое количество сока внутри. Чем его больше, тем лучше. Именно от количества сока, который играет роль электролитического раствора, зависит успех эксперимента.
После этого нужно закрепить на батарейке из лимона электроды. С одной стороны аккуратно вставляем положительный (медная монета), а с другой стороны -отрицательный (цинковый болт) электроды. Лучше вставлять их примерно на треть или половину длины, оставляя место для проводков.
Еще один важный момент — электроды не должны прикасаться друг к другу ни внутри, ни снаружи фрукта. Иначе обязательно возникнет короткое замыкание.
Сверху на электроды необходимо аккуратно закрепить проводки. Если они будут иметь зажимы на концах, то это существенно облегчит процесс и упросит задачу.

Сборка батарейки из лимона
Выполните сборку батарейки с имеющимися гвоздями и присоединенными к ним проводами.
- Вставьте гвоздь в половинку лимона. Другую его часть с медной проволокой подключите к следующему кусочку.
- Таким же образом соедините всю конструкцию. В одном из ее крайних элементов должен быть гвоздь с проволокой, в другом – только провод.
- Плюс на этой батарейке появляется там, где находится никелированный гвоздь. А минус – где медный провод.

- Теперь замерьте напряжение мультиметром, чтобы узнать, сколько выдает батарейка из лимона. Если такого устройства нет, то делать это не обязательно.
- Приблизьте контакты друг к другу и подключите к светодиоду.
- Выключите свет, и увидите огонек внутри лампочки.

Таким образом, из подручных средств можно изготовить лимонную батарейку. Попробуйте собрать эту крутую самоделку из лимона вместе с детьми. Это очень интересно и занимательно.

 Биотопливо для авто. Топливо XXI века?
Биотопливо для авто. Топливо XXI века? Технологические особенности производства биотоплива
Технологические особенности производства биотоплива Великая миссия. Биотопливо из мусора
Великая миссия. Биотопливо из мусора Вихревой теплогенератор: принцип действия, преимущества, схемы и рекомендации для самостоятельной сборки
Вихревой теплогенератор: принцип действия, преимущества, схемы и рекомендации для самостоятельной сборки





